Moin, bin der Rudi 31 und habe mit Interesse den thread hier gelesen. habe mir an auch gleich mal die entsprechenden Sachen organisiert und an gemischt. habe mir eine KH 4 und KH 2 Lösung mit Destilliertem Wasser und Natriumkarbonat an gemischt. Das Bromthymolblau Pulver habe ich einmal mit Brennspiritus und einmal mit Destillieren Wasser gemischt. Habe zuerst die KH2 und KH4 Lösung mit dem Spiritus Gemisch getestet und ich musste feststellen das sich die KH4 Lösung grün und die KH2 Lösung gelb verfärbt. Daraufhin habe ich beide Lösungen mit der Destilliertem Wasser BTB Lösung getestet mit dem selben Ergebnis. Habe ich da was falsch gemacht? Beeinflusst das Verhältnis von BTB und KH Lösung die Farbe mit? Habe Beide Lösungen auch mal in einem größeren Gefäß ca. 20ml getestet und da ist die KH 4 Lösung blau geworden die andere aber nicht.
Du verwendest einen veralteten Browser. Es ist möglich, dass diese oder andere Websites nicht korrekt angezeigt werden.
Du solltest ein Upgrade durchführen oder einen alternativen Browser verwenden.
Du solltest ein Upgrade durchführen oder einen alternativen Browser verwenden.
CO2 Langzeittest
- Ersteller Tobias Coring
- Erstellt am
flashmaster
Member
Hy
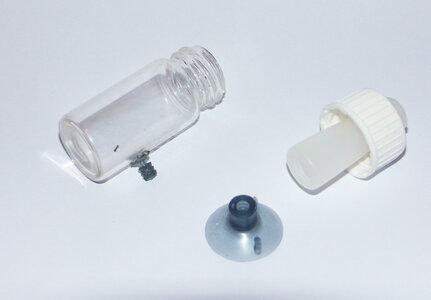
habe mir laut der Anleitung die Dauertestlösung auch selbst angemischt
und wollte Euch meinen Eigenbau Dauertest nicht vorenthalten
zwar vllt nicht ganz so schön wie die gekauften Varianten aber er funzt
benutzt habe ich
1 Fläschchen vom JBL Testkoffer
1 "weisses" Röhrchen (das liegt z.B. bei Salben bei für den Intimbereich von Frauen , ich habe einige neue so bekommen dank eines netten Frauenarztes )
)
was aber auch gut funktionieren könnte ist ein Stück eines Bürstenkopfes (das untere Teil) von einer E-Zahnbürste
und einen Gummisauger für Luftleitungen fürs Aqua
Loctite 424 Industriesekundenkleber
als erstes hab ich die Dichtung aus dem Deckel des Fläschchens entfernt und auf den Durchmesser des Röhrchens in der Mitte aufgeschnitten
als zweites beim Deckel des Fläschchens die Mitte markiert und auf den Durchmesser des Röhrchens aufgebohrt
dann das Röhrchen mit einem Cuttermesser auf Länge gebracht
dann das Röhrchen mit dem Deckel verklebt ( leider sind von den Vorarbeiten keine Bilder vorhanden )
ich nutze für solche Verklebungen immer Loctite 424 oder Loctite Gel (beim überbrücken größerer Spalte)
da das ein Sekundenkleber ist der extreme fest wird und fast alle Materialien miteinander verklebt
nach dem trocknen die angepasste Dichtung wieder eingebaut , und dann das ganze wieder miteinander verschraubt
danach habe ich den "Halter" des Gummisaugers gekürzt so das er auf der Seite des Fläschchens plan aufliegt und diesen wiederum mit Loctite verklebt und den Sauger wieder draufgesteckt
dann das ganze befüllt und ab ins Aqua
der Vorteil des Ganzen , man kann es zum tauschen der Flüssigkeit öffnen und dur´ch das weisstransparente Röhrchen kann man ihn sehr gut ablesen
so jetzt noch ein paar Bilder
auf dem ersten die kompletten Einzelteile
hier das Röhrchen auseinandergenommen und auf dem zweiten Bild die Markierung der ungefähren Länge wo ich es abgetrennt habe
hier der Dauertest kurz vorm zusammenbaun
und hier im Aqua
habe mir laut der Anleitung die Dauertestlösung auch selbst angemischt
und wollte Euch meinen Eigenbau Dauertest nicht vorenthalten
zwar vllt nicht ganz so schön wie die gekauften Varianten aber er funzt
benutzt habe ich
1 Fläschchen vom JBL Testkoffer
1 "weisses" Röhrchen (das liegt z.B. bei Salben bei für den Intimbereich von Frauen , ich habe einige neue so bekommen dank eines netten Frauenarztes
was aber auch gut funktionieren könnte ist ein Stück eines Bürstenkopfes (das untere Teil) von einer E-Zahnbürste
und einen Gummisauger für Luftleitungen fürs Aqua
Loctite 424 Industriesekundenkleber
als erstes hab ich die Dichtung aus dem Deckel des Fläschchens entfernt und auf den Durchmesser des Röhrchens in der Mitte aufgeschnitten
als zweites beim Deckel des Fläschchens die Mitte markiert und auf den Durchmesser des Röhrchens aufgebohrt
dann das Röhrchen mit einem Cuttermesser auf Länge gebracht
dann das Röhrchen mit dem Deckel verklebt ( leider sind von den Vorarbeiten keine Bilder vorhanden )
ich nutze für solche Verklebungen immer Loctite 424 oder Loctite Gel (beim überbrücken größerer Spalte)
da das ein Sekundenkleber ist der extreme fest wird und fast alle Materialien miteinander verklebt
nach dem trocknen die angepasste Dichtung wieder eingebaut , und dann das ganze wieder miteinander verschraubt
danach habe ich den "Halter" des Gummisaugers gekürzt so das er auf der Seite des Fläschchens plan aufliegt und diesen wiederum mit Loctite verklebt und den Sauger wieder draufgesteckt
dann das ganze befüllt und ab ins Aqua
der Vorteil des Ganzen , man kann es zum tauschen der Flüssigkeit öffnen und dur´ch das weisstransparente Röhrchen kann man ihn sehr gut ablesen
so jetzt noch ein paar Bilder
auf dem ersten die kompletten Einzelteile
hier das Röhrchen auseinandergenommen und auf dem zweiten Bild die Markierung der ungefähren Länge wo ich es abgetrennt habe
hier der Dauertest kurz vorm zusammenbaun
und hier im Aqua
Anhänge
Simon
Active Member
Hallo,
Dann hast Du noch nicht richtig gesucht. Es gibt auch mehr Varianten und Bauarten, als den, mit der "abhängenden" Kugel.
Konsti":1tb4kxt0 schrieb:Hi,
die Idee gefällt mir gut, wäre cool wenns sowas mal auch aus Glas geben würde. Die normalen Dauertest sind mir schon wieder zu langeweilig
Dann hast Du noch nicht richtig gesucht. Es gibt auch mehr Varianten und Bauarten, als den, mit der "abhängenden" Kugel.
flashmaster
Member
Hy
danke , das Euch meine kleine Bastelei gefällt
@Konsti
ja das Dennerle Ei ist nicht aus Glas sondern Plastik und sieht nach einer Weile nicht mehr wirklich schön aus
selbst wenn man es immer wieder reinigt , das Plaste verfärbt sich nun mal leicht
hab ja selbst eins im Einsatz
danke , das Euch meine kleine Bastelei gefällt
@Konsti
ja das Dennerle Ei ist nicht aus Glas sondern Plastik und sieht nach einer Weile nicht mehr wirklich schön aus
selbst wenn man es immer wieder reinigt , das Plaste verfärbt sich nun mal leicht
hab ja selbst eins im Einsatz
Yacimov
Member
Hi,
hier wird immer KH=4 empfohlen, weil dann bei grüner Reaktion von BTM (also pH=7) die idealen 30 mg/l CO2 im Wasser des Dauerstest vorliegen sollen. Mit meinen Tabellenwerten und v.a. mit dem Berechnungstool von Olaf Deters komme ich aber auf andere Werte, nämlich dass die KH möglichst bei 8° liegen sollte. Wo liegt mein Denkfehler?
Merci und Grüße, Basti
hier wird immer KH=4 empfohlen, weil dann bei grüner Reaktion von BTM (also pH=7) die idealen 30 mg/l CO2 im Wasser des Dauerstest vorliegen sollen. Mit meinen Tabellenwerten und v.a. mit dem Berechnungstool von Olaf Deters komme ich aber auf andere Werte, nämlich dass die KH möglichst bei 8° liegen sollte. Wo liegt mein Denkfehler?
Merci und Grüße, Basti
Hi Basti,
das sind keine fixen Werte. Die KH8 konnte ich weder rauslesen noch hätte ich eine Idee was das soll. Dort werden übrigens 20mg/l CO2 als günstig erwähnt.
Dort werden übrigens 20mg/l CO2 als günstig erwähnt.
Mir sind 30mg/l definitiv zu viel, für mich gibt es keine Notwendigkeit für >20mg/l CO2. Also benutze ich die KH3 Reagenz. Wenn es 15mg/l sind kann das auch funktionieren. Das kann auch noch niedriger sein, dann macht eine Regelung Sinn.
Für mich muss sich das in einem Bereich von 15-20mg/l CO2 und einem pH von 6,3 - 7 bewegen. Der pH-Bereich hat seine Ursache in der günstigen Nährstoffverfügbarkeit. Wenn sich das mit der gegebenen KH einrichten lässt, dann ist es gut, wenn nicht, dann wird die KH in den entsprechenden Bereich gebracht. Eigentlich einfach.
Gruß, Nik
das sind keine fixen Werte. Die KH8 konnte ich weder rauslesen noch hätte ich eine Idee was das soll.
Mir sind 30mg/l definitiv zu viel, für mich gibt es keine Notwendigkeit für >20mg/l CO2. Also benutze ich die KH3 Reagenz. Wenn es 15mg/l sind kann das auch funktionieren. Das kann auch noch niedriger sein, dann macht eine Regelung Sinn.
Für mich muss sich das in einem Bereich von 15-20mg/l CO2 und einem pH von 6,3 - 7 bewegen. Der pH-Bereich hat seine Ursache in der günstigen Nährstoffverfügbarkeit. Wenn sich das mit der gegebenen KH einrichten lässt, dann ist es gut, wenn nicht, dann wird die KH in den entsprechenden Bereich gebracht. Eigentlich einfach.
Gruß, Nik
Yacimov
Member
Hi Nik,
danke für deine Antwort, aber ich glaube, du hast mich missverstanden: Ich möchte weder eine Diskussion darüber vom Zaun brechen, welcher CO2-Gehalt im AQ-Wasser anzustreben ist, noch welche KH im AQ-Wasser sinnvoll ist.
Mir geht es vielmehr um die Frage, wie das in diesem thread über die CO2-Dauermessung immer wieder genannte Wertepaar für die Testflüssigkeit entstanden ist; also die Aussage, dass KH=4 und pH=7 (aus grüner Farbreaktion von BTM) auf einen CO2-Gehalt von 30mg/l hinweisen. Sind das reine Erfahrungswerte?
Denn: Eigentlich resultieren aus diesem Wertepaar ein anderer, deutlich geringerer CO2-Gehalt, nämlich 11 mg/l.
Wenn ich so darüber nachdenke, erscheint mir folgendes als plausibel: Das Berechnungstool von Olaf Deters und andere Tabellenwerke (z.B. von H.J. Krause) setzen ja immer Standardionenverteilung und die Abwesenheit von anderen Säuren und Basen als Kohlensäure voraus. Diese Voraussetzung ist aber natürlich in dem Moment nicht mehr erfüllt, wenn wir die KH mit Natriumcarbonat (Na2CO3) einstellen - das schließlich deutlich als Base reagiert und den pH-Wert entsprechend anhebt. Wenn diese Überlegung korrekt ist, sollte sich unser Rezept für das Anmischen der Testflüssigkeit deutlich vereinfachen lassen, zum einen, weil man dann das überall erhältliche Natriumhydrogencarbonat (=NaHCO3, Natriumbicarbonat, Haushaltsnatron, Kaisernatron) verwenden kann; zum anderen, weil jeder von uns den von ihm persönlich bevorzugten CO2-Gehalt selber einstellen kann.
Vorschlag für ein neues Rezept:
1) Man legt fest, wieviel CO2 man im AQ-Wasser haben möchte.
2) Man berechnet (z.B. hier), welchen KH-Wert die Testflüssigkeit bei pH=7 haben muss, um den gewünschten CO2-Wert anzuzeigen.
3.) Man stellt sich eine Testflüssigkeit mit entsprechendem KH-Wert her.
Hierbei gilt: 30 mg Natron erhöhen die KH in 1l Wasser um 1°.
4) Zugabe des Indikators Bromthymolblau ("BTB") - soviel, dass eine deutlich gefärbte Lösung erhalten wird. (Jedoch auch nicht zu viel, da BTB als pH-Puffer reagieren und dann das Ergebnis verfälschen kann).
Beispiel 1:
CO2 soll bei 30mg/l liegen
KH muss dann auf 10,57 eingestellt werden
Hierzu löst man 10,57 * 30 mg = 0,32 g Natron in einem Liter destilliertem Wasser
[oder: man löst 3,2 g in einem Liter Wasser und verdünnt anschließend, indem man von der ersten Lösung 10 ml nimmt und auf 100 ml auffüllt]
Beispiel 2:
CO2 soll bei 10 mg/l liegen
KH = 3,52
m(NaHCO3) = 0,11 g
Bitte gebt mir ein Feedback, ob ich mich hier irgendwo verhauen habe :wink:
Grüße, Basti
danke für deine Antwort, aber ich glaube, du hast mich missverstanden: Ich möchte weder eine Diskussion darüber vom Zaun brechen, welcher CO2-Gehalt im AQ-Wasser anzustreben ist, noch welche KH im AQ-Wasser sinnvoll ist.
Mir geht es vielmehr um die Frage, wie das in diesem thread über die CO2-Dauermessung immer wieder genannte Wertepaar für die Testflüssigkeit entstanden ist; also die Aussage, dass KH=4 und pH=7 (aus grüner Farbreaktion von BTM) auf einen CO2-Gehalt von 30mg/l hinweisen. Sind das reine Erfahrungswerte?
Denn: Eigentlich resultieren aus diesem Wertepaar ein anderer, deutlich geringerer CO2-Gehalt, nämlich 11 mg/l.
Wenn ich so darüber nachdenke, erscheint mir folgendes als plausibel: Das Berechnungstool von Olaf Deters und andere Tabellenwerke (z.B. von H.J. Krause) setzen ja immer Standardionenverteilung und die Abwesenheit von anderen Säuren und Basen als Kohlensäure voraus. Diese Voraussetzung ist aber natürlich in dem Moment nicht mehr erfüllt, wenn wir die KH mit Natriumcarbonat (Na2CO3) einstellen - das schließlich deutlich als Base reagiert und den pH-Wert entsprechend anhebt. Wenn diese Überlegung korrekt ist, sollte sich unser Rezept für das Anmischen der Testflüssigkeit deutlich vereinfachen lassen, zum einen, weil man dann das überall erhältliche Natriumhydrogencarbonat (=NaHCO3, Natriumbicarbonat, Haushaltsnatron, Kaisernatron) verwenden kann; zum anderen, weil jeder von uns den von ihm persönlich bevorzugten CO2-Gehalt selber einstellen kann.
Vorschlag für ein neues Rezept:
1) Man legt fest, wieviel CO2 man im AQ-Wasser haben möchte.
2) Man berechnet (z.B. hier), welchen KH-Wert die Testflüssigkeit bei pH=7 haben muss, um den gewünschten CO2-Wert anzuzeigen.
3.) Man stellt sich eine Testflüssigkeit mit entsprechendem KH-Wert her.
Hierbei gilt: 30 mg Natron erhöhen die KH in 1l Wasser um 1°.
4) Zugabe des Indikators Bromthymolblau ("BTB") - soviel, dass eine deutlich gefärbte Lösung erhalten wird. (Jedoch auch nicht zu viel, da BTB als pH-Puffer reagieren und dann das Ergebnis verfälschen kann).
Beispiel 1:
CO2 soll bei 30mg/l liegen
KH muss dann auf 10,57 eingestellt werden
Hierzu löst man 10,57 * 30 mg = 0,32 g Natron in einem Liter destilliertem Wasser
[oder: man löst 3,2 g in einem Liter Wasser und verdünnt anschließend, indem man von der ersten Lösung 10 ml nimmt und auf 100 ml auffüllt]
Beispiel 2:
CO2 soll bei 10 mg/l liegen
KH = 3,52
m(NaHCO3) = 0,11 g
Bitte gebt mir ein Feedback, ob ich mich hier irgendwo verhauen habe :wink:
Grüße, Basti
Hi Basti,
deine Berechnung ist leider falsch. Bzw. weiß ich nicht wo du den pH von 7 herbekommen hast? Am Anfang des Threads steht zwar von Christian, dass die Farbreaktion bei pH 7 beginnt, jedoch nicht, dass man den pH von 7 mit einem CO2 Gehalt von 30 mg/l gleichsetzt. Die KH von 4 und auch von 3 kann man rechnerisch dem passenden Farbwert zuordnen.
Um einen CO2 Wert von 30 mg/l zu erhalten musst du eine KH von 4 in der Lösung fix einstellen. Der passende Farbumschlag geschieht bei einem pH von ~6,6. Bei einem pH von 7 schlägt das blau erstmals in ein blau/grün um. Das leuchtende passende grün erreicht man jedoch erst bei einem pH von 6,6.
Mit Kaisernatron funtioniert der Umschlag des BTB nicht so wie mit dem Natron. Das wurde ja schon alles vorweg ausgiebig getestet.
Jeder kann sich aber natürlich selber seine KH Referenzlösung erstellen. Auf KH 3 oder KH 4 muss man das nicht einstellen. Die beiden KH Werte machen aber eben in Bezug auf 20 und 30 mg/l CO2 schon Sinn .
.
Eine KH 10 haut aber bzgl. einem CO2 Gehalt von 30 mg/l absolut nicht hin bzw. hat man dann lediglich ein dunkles grün. Der angepeilte Grünwert ist jedoch heller. (eben bei ca. pH 6,6). Lediglich
deine Berechnung ist leider falsch. Bzw. weiß ich nicht wo du den pH von 7 herbekommen hast? Am Anfang des Threads steht zwar von Christian, dass die Farbreaktion bei pH 7 beginnt, jedoch nicht, dass man den pH von 7 mit einem CO2 Gehalt von 30 mg/l gleichsetzt. Die KH von 4 und auch von 3 kann man rechnerisch dem passenden Farbwert zuordnen.
Um einen CO2 Wert von 30 mg/l zu erhalten musst du eine KH von 4 in der Lösung fix einstellen. Der passende Farbumschlag geschieht bei einem pH von ~6,6. Bei einem pH von 7 schlägt das blau erstmals in ein blau/grün um. Das leuchtende passende grün erreicht man jedoch erst bei einem pH von 6,6.
Mit Kaisernatron funtioniert der Umschlag des BTB nicht so wie mit dem Natron. Das wurde ja schon alles vorweg ausgiebig getestet.
Jeder kann sich aber natürlich selber seine KH Referenzlösung erstellen. Auf KH 3 oder KH 4 muss man das nicht einstellen. Die beiden KH Werte machen aber eben in Bezug auf 20 und 30 mg/l CO2 schon Sinn
Eine KH 10 haut aber bzgl. einem CO2 Gehalt von 30 mg/l absolut nicht hin bzw. hat man dann lediglich ein dunkles grün. Der angepeilte Grünwert ist jedoch heller. (eben bei ca. pH 6,6). Lediglich
Anhänge
Yacimov
Member
Hi Tobi,
mein Fehler war in der Tat, dass ich die grüne Farbreaktion von BTB einfach mit pH=7 gleichgesetzt habe. Stimmt natürlich, dass das leuchtende Grün etwas darunter bei ~6,6 liegt - und dann kommt man mit den Tabellenwerten ja auch gleich auf völlig andere Werte! Merci!
Allerdings verstehe ich nach wie vor nicht, warum das ganz mit Natron nicht geht, jedoch mit Natriumcarbonat - hattet ihr da irgendwann eine Erklärung für gefunden (ich habe die 11 Seiten dieses threads gestern überflogen, evtl. habe ich die Erklärung überlesen?)?.
Grüße, Basti
Nachtrag: Dass Natriumcarbonat eine ~starke Base ist, wohingegen Natriumhydrogencarbonat den pH-Wert nur ganz leicht anhebt ist mir klar, aber gerade dass sollte doch eigentlich für letzteres sprechen?!?
mein Fehler war in der Tat, dass ich die grüne Farbreaktion von BTB einfach mit pH=7 gleichgesetzt habe. Stimmt natürlich, dass das leuchtende Grün etwas darunter bei ~6,6 liegt - und dann kommt man mit den Tabellenwerten ja auch gleich auf völlig andere Werte! Merci!
Allerdings verstehe ich nach wie vor nicht, warum das ganz mit Natron nicht geht, jedoch mit Natriumcarbonat - hattet ihr da irgendwann eine Erklärung für gefunden (ich habe die 11 Seiten dieses threads gestern überflogen, evtl. habe ich die Erklärung überlesen?)?.
Grüße, Basti
Nachtrag: Dass Natriumcarbonat eine ~starke Base ist, wohingegen Natriumhydrogencarbonat den pH-Wert nur ganz leicht anhebt ist mir klar, aber gerade dass sollte doch eigentlich für letzteres sprechen?!?
Hi,
beim normalen Natron hat man das Problem, dass man den tiefen Blauton nicht erreicht und die Lösung von Beginn an ein eher grünlichen Farbschlag hat.
Christian hatte das irgendwo in diesem sehr langen Thema erklärt. Ich weiß jetzt auch nicht mehr wo .
.
Ich hatte nämlich zu Beginn auch mit Kaisernatron gearbeitet und damit keine so guten Ergebnisse erzielt.
beim normalen Natron hat man das Problem, dass man den tiefen Blauton nicht erreicht und die Lösung von Beginn an ein eher grünlichen Farbschlag hat.
Christian hatte das irgendwo in diesem sehr langen Thema erklärt. Ich weiß jetzt auch nicht mehr wo
Ich hatte nämlich zu Beginn auch mit Kaisernatron gearbeitet und damit keine so guten Ergebnisse erzielt.
Hi,
Christian ist promovierter Chemiker... irgendwo hat er auch erklärt warum man das Natron nehmen muss. Ich hab lediglich geschrieben, dass ich mich nicht mehr erinnern kann.
Kurz laienhaft zusammengefasst war es in etwa: BTB braucht eine Base, um den Blauton richtig anzuzeigen. Mit Kaisernatron bekommt man dies nicht hin => daher ist eben das Natron wichtig. Durch "Backen" kann man jedoch aus dem Kaisernatron => Natron erzeugen und dann passt es ja wieder bzgl. der Blaufärbung.
EDIT: hab eben das Thema nochmal durchsucht und auch nur Christians konkludente Lösung in Bezug auf den pH 7 => grün und der Schlussfolgerung das eine Base von Nöten ist gefunden.
Aber mir persönlich reicht das auch . Mit Kaisernatron klappt es eben nicht mit dem Blauton.
. Mit Kaisernatron klappt es eben nicht mit dem Blauton.
Christian ist promovierter Chemiker... irgendwo hat er auch erklärt warum man das Natron nehmen muss. Ich hab lediglich geschrieben, dass ich mich nicht mehr erinnern kann.
Kurz laienhaft zusammengefasst war es in etwa: BTB braucht eine Base, um den Blauton richtig anzuzeigen. Mit Kaisernatron bekommt man dies nicht hin => daher ist eben das Natron wichtig. Durch "Backen" kann man jedoch aus dem Kaisernatron => Natron erzeugen und dann passt es ja wieder bzgl. der Blaufärbung.
EDIT: hab eben das Thema nochmal durchsucht und auch nur Christians konkludente Lösung in Bezug auf den pH 7 => grün und der Schlussfolgerung das eine Base von Nöten ist gefunden.
Aber mir persönlich reicht das auch
Ähnliche Themen
- Antworten
- 35
- Aufrufe
- 6K
- Antworten
- 11
- Aufrufe
- 5K
- Antworten
- 3
- Aufrufe
- 2K
- Antworten
- 18
- Aufrufe
- 5K